第14章:故事是……以及未被讲述的
“当说到目前精神药物试验中的尸体(dead bodies)时,积极治疗组的尸体数量要多于安慰剂组。这与青霉素试验或真正有效的药物试验中所发生的情况大不相同。”——大卫·希利(David Healy),威尔士卡迪夫大学(Cardiff University)精神病学教授(2008)[1]
在20世纪20年代,美国中心地带有收音机的人经常收听KFKB电台,它可能是当时美国信号最强的电台,尽管KFKB电台的信号来自堪萨斯州小小的米尔福德。“接下来是约翰·R·布林克利(John R. Brinkley)博士向他在堪萨斯州和其他地方的朋友们的问候,”他们会听到,布林克利博士确实有一个非常惊人的故事要讲。1918年,他开始将山羊性腺移植到担心男性生殖力下降的老年男性的睾丸中,这是一个15分钟的手术,他告诉KFKB的听众,这项手术被证明“完全恢复”了性能力。这位好医生会解释说:“一个人随着他的性腺一同变老。”这种恢复活力的手术之所以奏效,是因为山羊组织“与人体组织融合并进行滋养,刺激人体腺体产生新的活动。[2]”
尽管布林克利的医学资历是可疑的,他只拥有堪萨斯城综合医科大学的学位,这是一个野鸡大学,他是一个出色的故事讲述者和广告天才。在最初的几次手术后,他向堪萨斯州的报纸讲述了自己的故事,不久,报纸刊登了他抱着第一个“山羊腺婴儿”的照片,这是一个经历过手术的老人的后代。年长的男人开始涌向米尔福德,每人付750美元的手术费,布林克利启动了他的宣传机器,他雇佣了三名新闻代理人来撰写报纸特写,然后分发给“有兴趣推广科学实验室最新进展的出版物”。当然,这些植入的文章包括来自满意客户的推荐信,例如芝加哥法学院校长J.J.Tobias,文章是这样写的:他捶胸顿足大喊:“我是个新男人!这是本世纪最伟大的事情之一!”布林克利建立了自己的“科学出版社”,并报道了他的手术有“90%到95%的成功率”,他解释说,这使身体恢复了正常的荷尔蒙“平衡”。1923年,当他开始在KFKB上播报他的故事后,他变得如此出名,以至于每天都有三千封信送到他的米尔福德医院。20世纪20年代末,他也许是美国最富有的“医生”。
最终,布林克利博士在医学史上赢得了一席之地,成为有史以来最伟大的骗子之一,当时美国医学协会把他定为庸医。但在推销他的山羊性腺手术时,他运用了经得起时间考验的广告技巧和讲故事的模式。他发表了一些看起来科学的文章,吸引媒体,声称成功率非常高,为手术如何发挥作用提供了生物学依据,并向记者提供了满意客户的评价。正如礼来和其他药品制造商所证明的那样,这是一套将精神药物转化为商业成功的可靠模式。
小谎、大谎,和一款重磅药物
今天,当百忧解上市时,礼来公司和精神病学讲述的百忧解故事的欺诈性质是众所周知的,彼得·布雷金(Peter Breggin)、大卫·希利(David Healy)和约瑟夫·格伦马伦(Joseph Glenmullen)等都有文件证明。当布雷金和希利成为民事诉讼的专家证人后写下调查文件,他们被允许获得礼来公司的文件,这使他们能够看到数据和内部备忘录,这些数据和备忘录掩盖了公众对该药的了解。尽管我们很熟悉该领域,我们还需要简要回顾一下这个故事,因为它将帮助我们清楚地看到,我们对“第二代”精神药物价值的社会幻想是如何形成的。礼来的百忧解营销被证明是其他公司在将其药品推向市场时效仿的一个模式,它涉及在科学文献中讲述一个虚假的故事,向媒体更大程度地炒作这个故事,并隐藏可能导致使用药物者致残和死亡的风险。
氟西汀(百忧解)的科学
药物研发从实验室开始,对一种药物的“作用机制”进行研究,正如我们之前了解到的那样,礼来的科学家们在上世纪70年代中期确定,氟西汀导致5-羟色胺在突触中“堆积”,进而引发大脑的一系列生理变化。接下来,在动物研究中,发现这种药物小鼠身上引起了刻板的活动(反复的嗅探、舔尝等)以及猫和狗的攻击性行为[3]。1977年,礼来在人类身上进行了首次小规模试验,但“完成四周治疗的8名患者中没有一人表现出明显的药物诱导的改善,”礼来的雷·富勒(Ray Fuller)在1978年告诉他的同事们。福勒说,该药还引起了“相当多的不良反应报告”。一名患者服用该药后出现精神病,其他患者则患有“静坐不能和坐立不安”[4]。
氟西汀的试验才刚刚开始,很明显,礼来有个大问题。氟西汀似乎没有解除抑郁,它引起的副作用静坐不能(akathisia),已知这会增加自杀和暴力的风险。在收到更多此类报告后,礼来修改了其试验方案,福勒在1979年7月23日写道:“在未来的研究中,将允许使用苯二氮类药物来控制静坐不能。[5]”苯二氮类药物将有助于减少静坐不能的报告,并可能提高疗效结果,因为对苯二氮类药物治疗抑郁症的几项试验表明,苯二氮类药物与三环类药物一样有效。当然,正如礼来公司的多萝西·多布斯(Dorothy Dobbs)后来在法庭上承认的那样,使用苯二氮类药物“在科学上是不好的”,因为它会“混淆结果”并“干扰对安全性和有效性的分析”,但它使公司能够继续开发氟西汀[6]。
尽管如此,即使增加了苯二氮类药物,氟西汀也未能表现出良好的效果。在20世纪80年代初,该公司在德国进行了该药的III期试验,1985年,德国授权机构联邦卫生部(BGA)得出结论认为该药“完全不适合治疗抑郁症”[7]。根据患者的“自我评分等级”(与医生的评价截然相反),该药对“患者的临床症状几乎没有反应或没有改善,”BGA指出[8]。同时,它导致精神病和幻觉,并增加了一些患者的焦虑、激动和失眠,BGA写道:“不良反应超过了医学标准所认为可接受的范围。[9]”最有问题的是,这种药物的治疗可能是致命的,BGA说:“共有16次自杀企图,其中两次成功。[10]”一名德国礼来员工私下计算,服用氟西汀的患者自杀行为的发生率“是服用其他有效药物丙咪嗪患者的5.6倍。[11]”
由于德国拒绝了它的申请,礼来自然担心它将无法获得FDA对氟西汀的批准(原注:1989年底,礼来公司获准在德国销售氟西汀,但其标签上警告:自杀风险会增加)。它需要隐藏自杀数据,在1994年的一次民事诉讼中,临床试验设计专家南希·洛德(Nancy Lord)解释了公司是如何做到的。首先,礼来指示研究人员将各种与药物相关的不良事件记录为“抑郁症状”,因此,在提交给FDA的试验结果中,这些问题是由疾病而不是氟西汀引起的。第二,当礼来公司的科学家们将病例报告表中的数据制成表格时,他们将个人关于“自杀意念”的报告改为“抑郁”。第三,礼来的员工审查了德国的数据,并“剔除了那些他们认为不是自杀的案例。[12]”
1994年洛德在法庭上说,所有这些诡计都使整个试验过程在科学上“毫无价值”。然而,即使有了这些统计数字上的处理,礼来公司仍难以在FDA的申请中为氟西汀提出令人信服的理由。它在8个试验点进行了安慰剂对照试验,其中4个试验点的氟西汀患者的表现并不比安慰剂组好,而在其他地方,氟西汀仅略好于安慰剂组[13]。同时,当彼得·布雷金审查礼来公司的文件时,他发现,在七项试验中,有六项试验证明丙咪嗪比氟西汀更有效[14]。FDA在1985年3月28日对一项大型试验的审查中也提出了同样的看法:“丙咪嗪显然比安慰剂更有效,而氟西汀则没有一致地好于安慰剂。[15]”充其量,氟西汀的疗效是微不足道的,FDA的评审员理查德·卡皮特(Richard Kapit)也担心它的安全性,在短期试验中,至少有39名接受氟西汀治疗的患者出现精神病,略多于1%的患者出现躁狂或轻躁狂,其他副作用包括失眠、紧张、混乱、头晕、记忆障碍、震颤和共济失调。卡皮特总结说,氟西汀“可能会对抑郁症患者产生负面影响。[16]”FDA还了解到礼来公司曾试图隐瞒其中的许多问题,根据审查员大卫·格雷厄姆(David Graham)的说法,该公司对氟西汀可能造成的危害进行了“大规模瞒报”[17]。
虽然这些试验在科学上可能毫无价值,但事实证明它们是对百忧解上市后发生的事情的准确预测。关于百忧解治疗的病人犯下骇人听闻的罪行或自杀的传闻层出不穷,如此之多的不良事件报告流入FDA的“药物监督网”项目,使百忧解迅速成为美国最受投诉的药物,到1997年夏天,FDA已经收到了三万九千份关于百忧解的报告,远远超过了这九年期间(1988-1997年)收到的任何其他药物的报告数量。药物监督网的文件中提到了成百上千的自杀事件,以及一长串令人烦恼的副作用,其中包括精神病性抑郁、躁狂、思维异常、幻觉、敌意、混乱、健忘症、抽搐、颤抖和性功能障碍[18]。据FDA估计,只有1%的不良事件上报给药物监督网,这表明,在这9年的时间里,大约有400万美国人对百忧解有不良甚至致命的反应[19]。
医学期刊上讲的故事
显然,氟西汀在临床试验中的记录并不能支持在市场的成功发布。公众不太可能接受一种药物,在最初的审查中,德国的许可证管理局认为“完全不适合”作为抑郁症的治疗方法。如果百忧解要取得成功,那么礼来花钱请来做试验的精神病学家需要在医学期刊和公众面前讲述一个完全不同的故事。
美国氟西汀试验的第一篇报道发表在1984年的《临床精神病学杂志》上。来自华盛顿西北精神药理学研究所(Northwest Psychopharmacology Research in Washington)的詹姆斯·布雷姆纳(James Bremner)写道,这种新型药物“提供了有效的抗抑郁活性,副作用比丙咪嗪要少得多……氟西汀患者报告的所有不良事件均未被认为与药物有关。”他补充说,氟西汀“证明比三环类抗抑郁药更有效。[20]”其次,来自圣地亚哥加利福尼亚大学(University of California)的约翰·费格纳(John Feigner)报告说,氟西汀的疗效至少与丙咪嗪相当(可能优于丙咪嗪),他对22名氟西汀患者进行了一项为期五周的研究,并称“没有发现严重的副作用”[21]。一个新主题已经被提出,一种非常安全和改进的抗抑郁药已经被开发出来,礼来的研究人员在随后的几年里坚持这一点。加利福尼亚精神病学家杰伊·科恩(Jay Cohn)在1985年报道:“氟西汀的耐受性比丙咪嗪更好。[22]”礼来的约阿希姆·韦尼克(Joachim Wernicke)在《临床精神病学杂志》上的另一篇文章中说:“这种药物,很少有严重的副作用。[23]”最后,在1985年关于其大型III期试验的报告中,礼来公司宣布“氟西汀在所有主要疗效参数上都比安慰剂有更大的改善。[24]”
虽然这些报告确实提到了一种优于老一代抗抑郁药的新药,但这仍然不是一种“突破性”药物的故事。人们不知道为什么这种药物效果更好,但随着FDA批准氟西汀的临近,一个新的“事实”开始出现在科学报告中。在1987年《英国精神病学杂志》的一篇文章中,西德尼·莱文(Sidney Levine)写道,“研究表明(5-羟色胺)缺乏在抑郁症的精神生物学中起着重要作用。[25]”虽然事实上并没有发现这一点,莱文显然忽略了1984年NIMH的报告,即“5-羟色胺能系统功能的提高或降低本身不太可能与抑郁有关”,这篇文章为氟西汀被吹捧为修复化学失衡的药物奠定了基础。两年后,路易斯维尔大学(University of Louisville)的精神病学家调查了氟西汀的文献,以提供“最新抗抑郁药的处方指南”,他们写道“抑郁症患者的脑脊液中的(5-羟色胺代谢物)浓度低于正常水平。”一种幻想的信念正在通过医学文献蔓延,于是,也许并不让人意外,肯塔基州的精神病学家得出结论,氟西汀,理论上可以提高5-羟色胺水平,是“治疗抑郁症的理想药物。[26]”
医学杂志上的这一系列报道为礼来向医生宣传其药物提供了有力的依据。这家公司在医学杂志上大量刊登广告,这些广告的主角是长相好看、散发幸福感的人,这些广告标榜百忧解的疗效与丙咪嗪相当,而且耐受性更好。科学已经证明,精神病学有一种治疗抑郁症的新的、大大改进的药丸,它似乎能纠正大脑中的化学失衡。
向公众讲的故事
在精神病学杂志上讲述的故事肯定会引起公众的共鸣。然而,此时此刻,抗抑郁药的市场规模仍然保持适中。百忧解获得批准后,华尔街分析师预测,百忧解将为礼来带来1.35亿至4亿美元的年销售额。但制药公司、美国精神病学协会(APA)和国立精神卫生研究所(NIMH)的领导人都热衷于扩大抗抑郁药的市场,NIMH的DART“公众意识”运动证明是一个达成目标的完美工具。
1986年,NIMH宣布了DART计划后,它研究了公众对抑郁症的看法。一项调查显示,只有12%的美国成年人会服用药物来治疗它,78%的人说他们“带病生活,直到它消失”,他们有信心自己处理。这一态度与NIMH在15年前所宣扬的一致,当时抑郁科主任迪恩·舒勒(Dean Schueller)曾告诉公众,大多数抑郁发作“将在没有特别干预的情况下,随着几乎完全康复而结束。”公众的流行病学智慧相信抑郁症会过去,但舍维特·弗雷泽和其他生物精神病学家掌舵后,就打算传达一个不同的信息。
NIMH在1988年解释道,DART的目的是“改变公众的态度,让人们更多地接受抑郁症是一种疾病而不是一种虚弱状态(weakness)”。公众需要明白,抑郁症经常“诊断不足,治疗不足”,如果不治疗,它可能会“成为一种致命的疾病”。NIMH说,有3140万美国人患有至少一种轻微形式的抑郁症,他们得到诊断是很重要的。需要让公众意识到使用抗抑郁药的康复率是“70%到80%,而安慰剂是20%到40%。”NIMH郑重宣布要无限期地继续DART项目,以便“告知”公众这些“事实”[27]。
NIMH于1988年5月正式启动DART项目,这是在百忧解上市5个月后。NIMH招募了“劳工、宗教、教育团体”和企业帮助其传播信息,当然,制药公司和全国精神病联盟(NAMI)从一开始就参与进来。NIMH在媒体上刊登广告,礼来帮助印刷和发行了800万本名为“抑郁症:你需要知道的”的DART小册子。这本小册子向读者介绍了治疗这种疾病的“5-羟色胺能”药物的独特优点。NIMH主任路易斯·贾德说:“通过在全国各地的医生办公室里提供这些关于抑郁症的材料,重要的信息可以有效地在鼓励提问、讨论、治疗或转诊的场景中传播给公众。[28]”
美国人思想的重塑正在进行,这种以“公众教育”为幌子的抑郁药物营销,变成了有史以来最有效的营销手段之一。报纸开始注意到这个故事,百忧解的销量开始飙升,然后,1989年12月18日,当《纽约》杂志把它登上封面时,这种绿白相间的药丸正式获得了明星的地位,标题疾呼:“再见,再见忧郁:一种治疗抑郁症的新药”。在这篇文章中,一位“匿名”的百忧解用户说,从1分到100分,他现在感觉“超过100分”。该杂志总结道,多亏了这种新的奇迹药丸,精神科医生们感到他们的“职业身份得到了鼓舞”[29]。
其他类似的精彩故事很快就接踵而至,1990年3月26日,《新闻周刊》的封面是绿白相间的胶囊漂浮在美丽的风景上。《新闻周刊》报道了“百忧解:一种治疗抑郁症的突破性药物”,医生们每个月都要为这种药物开出65万张处方,“几乎每个人都对这种新疗法说句好话。”病人们大声喊道:“我从来没有感觉好过![30]”三天后,《纽约时报》的娜塔莉·安吉尔(Natalie Angier)解释说,抗抑郁药“通过恢复大脑中神经递质活动的平衡,通过纠正电化学信号的异常过度或不足,来控制情绪、思想、欲望、疼痛和其他感觉。”弗朗西斯·蒙迪莫尔(Francis Mondimore)博士告诉安吉尔:“这种新药不像酒精或安定,而像抗生素。[31]”电视节目也传达了类似的信息,在60分钟的时间里,莱斯利·斯塔尔(Lesley Stahl)讲述了一位名叫玛丽亚·罗梅罗(Maria Romero)的患者令人鼓舞的故事,她在经历了十年可怕的抑郁症之后,通过百忧解获得了新生,罗梅罗说:“有人,有东西离开了我的身体,另一个人进来了。”斯塔尔高兴地解释了生物疗法的作用:“大多数医生认为像罗梅罗那样的慢性抑郁症是由大脑中的化学失衡引起的,为了纠正,医生开了百忧解。[32]”
用山达基教来补救
很早以前,这个特效药的故事曾一度濒临破碎,当然,问题是氟西汀确实在一些人中引起了自杀和暴力的念头,1990年夏天,百忧解的安全问题突然成为新闻。就在那时,在那个关键时刻,山达基被证明对礼来和精神病学相关机构非常有用。
到1990年,许多人对氟西汀产生了不良反应,于是成立了一个全国百忧解幸存者支持小组。许多受药物伤害的人都向律师投诉,特别是两起诉讼引起了公众的注意。首先,7月18日,报纸报道了一名长岛妇女罗达·哈拉(Rhoda Hala)起诉礼来,因为在服用百忧解后,她割腕和“身体其他部位数百次”[33]。两周后,报纸报道了一桩与肯塔基州一名疯狂男子犯下的大规模谋杀案有关的诉讼,开始用药五周后,约瑟夫·韦斯贝克(Joseph Wesbecker)走进他曾经工作过的路易斯维尔印刷厂,用一支AK-47突击步枪开火,造成8人死亡,12人受伤。公民人权委员会很快发布了一份新闻稿,敦促国会禁止使用这种“杀手药物”,礼来公司就在这时发起了反攻,礼来大声宣布,这些诉讼“是山达基集团鼓动起来的,该集团曾有批评使用精神药物的历史。[34]”
这是礼来拯救其轰动一时的药物运动的开始。首席医疗官利·汤普森(Leigh Thompson)在1990年的一份痛苦的备忘录中写道:“如果我们失去百忧解,礼来公司可能会一落千丈。[35]”公司迅速向媒体传达了四点信息:这是山达基教徒提出的问题;大量的临床试验表明,百忧解是一种安全的药物;自杀和杀人事件“是由于疾病,而不是药物;以及“那些可以得到帮助的人被吓跑了,而这才是真正的公众威胁。[36]”该公司为它聘请的学术界精神病学家顾问办了一个媒体培训会议,让他们练习如何传达这一信息。1991年4月,公司副总裁米奇·丹尼尔斯(Mitch Daniels)在一次这样的培训后向汤普森抱怨:“坦白说,我对我们外部专业人士的表现并不满意。”他说,公司将“授权给”在“未来的培训课程”中表现更好的学术精神病学家[37]。
1991年4月19日发表在《华尔街日报》上的一篇文章显示,礼来的培训课程取得了成效。该报告诉读者:“山达基”是一个“准宗教/商业/准军事组织”,正在“对精神病学发动战争”,尽管“与礼来无关的医生”在临床试验中发现,“与其他抗抑郁药或淀粉胶囊相比,服用百忧解的自杀倾向要低一些”。利·汤普森说:“看到医生和科学家二十年来的坚实研究,被山达基主义者和律师们的二十秒声音大声叫停,这是一个令人泄气的揭露。”事实上,《华尔街日报》报道,礼来在回应对百忧解安全性的担忧时,曾要求“自杀方面的专家”重新审查试验数据,但他们“得出结论,在临床试验中,抑郁症患者常见的自杀想法与百忧解无关。”麻省总医院(Massachusetts General Hospital)的哈佛精神病学家杰罗尔德·罗森鲍姆(Jerrold Rosenbaum)解释说:这是疾病,而不是药物,那是一场悲剧。“公众对百忧解的恐惧作为这场运动的结果,本身已经成为一个潜在的严重公共卫生问题,因为人们远离治疗。[38]”
当然,罗森鲍姆是礼来公司的“外部专业人士”之一。正如《波士顿环球报》后来报道的那样,他“在百忧解推出前曾担任礼来公司的营销顾问团成员”,他与礼来的关系“很融洽”[39]。但《华尔街日报》将他列为独立的专家,美国顶尖的抑郁症医生之一,因此读者只能得出一个结论:这是一个有害的山达基主义者凭空想象出来的问题,而不是一个合理的担忧。同年5月,其他报纸和杂志也以这种方式描述了这个问题,《时代》杂志在封面上对山达基教进行了严厉的报道,称其为吸引“精神病患者”的“犯罪组织”[40]。
1991年9月20日,FDA召开了一次听证会,讨论百忧解是否会增加自杀风险,但由与制药公司有关系的医生组成的咨询小组对认真调查这个问题几乎没有兴趣,尽管有二十多名市民就这种药物可能造成的危害作证,但专家小组确保科学讨论仅限于支持礼来观点的陈述,即氟西汀是完全安全的。正如《华尔街日报》报道的那样,听证会上展示的科学数据证明了“氟西汀不会导致更多的自杀或自杀想法,事实上,它表明这种药物有助于缓解这些症状。”礼来的一位支持者告诉《华尔街日报》,整场争论都是“完全编造的”,是“由一个反精神病学的团体组织和资助的。[41]”
在那一刻,礼来和所有的精神病学都取得了具有持久重要性的公关胜利。围绕着百忧解的神奇药物光环已经恢复,公众和媒体已经习惯于将批评精神药物与山达基教联系起来。关于这些药物的价值的争论现在看来一方是美国顶尖的科学家和医生,另一方是宗教狂人,如果真是这样,公众就可以确定真相在哪里了。其他的SSRIs上市后,1992年百忧解的销售额达到10亿美元大关,然后在1993年,布朗大学(Brown University)的精神病学家彼得·克莱默(Peter Kramer)在他的《神奇百忧解(Listening to Prozac)》一书中,将神奇药物的故事推向了一个新的高度。他写道,百忧解正在使一些病人“比好更好”,克莱默认为,“美容精神药理学”的时代正在到来,精神病学可能在不久的将来会有一些药片,可以给正常人提供他们想要的任何人格。他的书在《纽约时报》的畅销书排行榜上停留了21周时间,《新闻周刊》很快就警告读者,现在是社会开始努力解决精神病学新力量所提出的伦理问题的时候了。1994年《新闻周刊》解释说:“对大脑的科学洞察导致了百忧解的发展,同样的科学洞察将使人们看到完全定制化、现成个性的未来前景。”该杂志问道,那些拒绝“改造大脑”的人会被甩在后面吗?
神经精神学家理查德·雷斯塔克(Richard Restak)盛赞:“人类历史上第一次,我们将能够设计我们自己的大脑。[42]”
被愚弄的美国
当百忧解的故事在媒体上展开报道时,约翰·布林克利的鬼魂肯定在某处微笑,他用移植山羊性腺的奇迹故事让听众们聚精会神地听他的广播节目,而现在这个讲故事的过程将一种“完全不适合”治疗抑郁症的药物转变成了一种神奇的化合物,精神病学家们在公开场合绞尽脑汁地使出他们上帝一般的能力来塑造人们的思想。他们是否应该担心让人变得“比好更好”?如果每个人都一直快乐,我们的社会会失去一些宝贵的东西吗?对美国人思想进行广泛的“药物治疗”现在正在进行中,一个非常简短的回顾将揭示,正是这个相同的讲故事过程,支持了阿普唑仑作为一种治疗惊恐障碍的药物和非典型抗精神病药治疗精神分裂症的开始。一旦当这些“第二代”药物变得风靡一时,制药公司和学界精神病学家就开始兜售各种用于儿童的精神药物,这种讲故事的方式将数百万美国青年扫进了“精神病”的垃圾箱。
阿普唑仑
1981年,佳乐定(阿普唑仑)被FDA批准为抗焦虑药,随后普强药厂开始着手将其获批用于惊恐障碍,这在DSM-III(1980)中首次被确定为一种独立的疾病。作为第一步,它聘请了前NIMH主任杰拉尔德·科勒曼作为“指导委员会”共同主席负责试验过程,并向《普通精神病学档案(Archives of General Psychiatry)》的编辑丹尼尔·弗里德曼(Daniel Freedman)支付报酬,作为其“医疗事务部”的助理[43]。这只是该公司与学界精神病学合作的一部分,伦敦精神病学研究所(Institute of Psychology)的焦虑症专家艾萨克·马克斯(Isaac Marks)说:“世界上最资深的精神病学家都收到了来自普强的咨询服务的邀请。[44]”
科勒曼和普强药厂设计了普强跨国合作惊恐障碍研究,设计的试验方法在安慰剂组可预期产生较差的反应。曾经服用过苯二氮类药物的患者被允许进入这项研究,事实上,这意味着安慰剂组中的许多人会经历苯二氮类药物戒断的恐惧症状,因此在试验的最初几周可能会极度焦虑。将近四分之一的安慰剂患者在治疗期开始时血液中含有苯二氮类药物[45]。
已知苯二氮类药物起效很快,这项研究证明了这一点。4周结束时,82%的阿普唑仑患者“中度改善”或“好转”,而安慰剂组为43%。然而,在接下来的4周里,安慰剂组患者继续改善,而阿普唑仑组患者没有改善,到第8周结束时,在大多数评分量表上“两组之间没有显著差异”,至少在仍在研究中的患者中是如此。阿普唑仑组还经历了各种令人不安的副作用:镇静、疲劳、口齿不清、健忘和协调性差。每26名阿普唑仑患者中就有一名患者对药物有“严重”反应,如躁狂或攻击性行为[26]。
在8周结束时,患者用了4周逐渐较少服药,然后在不服药的情况下再随访两周,结果是可以预测的。39%停用阿普唑仑的患者“严重恶化”,他们的恐慌和焦虑急剧上升,以至于不得不再次开始服用药物。35%的阿普唑仑患者出现了比研究开始时更严重的“反跳性”恐慌和焦虑症状,同样比例的患者出现了一系列令人衰弱的新症状,包括意识混乱、感觉增强、抑郁、皮肤昆虫爬行感、肌肉痉挛、视力模糊、腹泻、食欲下降、体重减轻[47]。
总而言之,在14周结束时,接触药物的患者比安慰剂组更糟糕:他们更恐惧、更焦虑、更恐慌,在评估整体状况的“总体量表得分”上表现更差。44%的人无法脱离药物,正走上通往终生成瘾的道路。从各个方面来说,研究结果都描绘了一幅强有力的苯二氮陷阱的图景:这是一种在短时间内起作用的药物,然后它相对安慰剂的疗效逐渐减弱,然而当病人试图戒掉这种药物时,他们变得相当不适,许多人无法戒除这种习惯。最初几周的缓解是以很高的长期的代价来实现的,正如之前的苯二氮研究所显示的那样,那些坚持服用药物的人最终可能会在身体、情感和认知功能上受损。
阿普唑仑研究
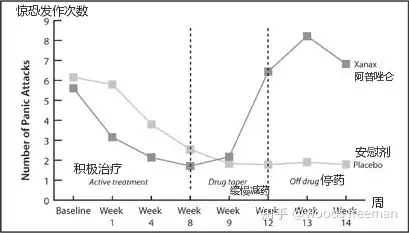
在普强药厂对阿普唑仑的研究中,患者接受药物或安慰剂治疗8周,然后治疗慢慢地停用(第9周到第12周),在最后的两周里,患者没有接受任何治疗。阿普唑仑患者在最初4周的表现更好,这是普强研究人员在他们的期刊文章中关注的结果。然而,一旦阿普唑仑患者开始停用药物治疗,他们比安慰剂患者遭受更多的惊恐发作,并且在研究结束时症状更加明显。资料来源:Ballenger, C “Alprazolam in panic disorder and agoraphobia.” Archives of General Psychiatry 45 (1988): 413–22. Pecknold, C “Alprazolam in panic disorder and agoraphobia.” Archives of General Psychiatry 45 (1988): 429–36.
1988年5月,普强的研究人员在《普通精神病学档案》上发表了三篇文章,任何仔细查看数据的人都可以看到阿普唑仑的危害。但是为了让阿普唑仑成功上市,普强需要它的研究人员得出不同的结论,他们也这样做了,尤其是在这三篇文章的摘要中。首先,他们把注意力集中在4周的结果上(而不是治疗期结束时的8周结果),宣布“阿普唑仑被发现有效且耐受性良好。[48]”接下来,他们注意到84%的阿普唑仑患者已经完成了为期8周的研究,这是“病人对阿普唑仑的接受度很高”的证据。尽管他们的阿普唑仑患者经常表现出诸如“说话口齿不清、健忘”和其他“精神状态受损”的症状,但他们仍然得出结论,这种药“副作用小,耐受性好”[49]。最后,他们承认一些阿普唑仑患者在停药时表现不佳,他们认为该药使用时间太短,停药太突然,他们说:“我们建议惊恐障碍患者接受更长时间的治疗,至少6个月。[50]”
在伦敦,艾萨克·马克斯和他在精神病学研究所的几个同事随后指出,这一切是多么的荒谬。在致《普通精神病学档案》的一封信中,他们观察到,由于阿普唑仑患者在研究结束时“状态比接受安慰剂的患者更糟糕”,普强研究人员关于该药物有效且耐受性良好的发现只能被视为“有偏见和有争议的”[51]。整个事件,马克斯随后写道,“这是一个由企业资助的研究(药物)危害的典型示范。[52]”
但是,事实上阿普唑仑患者的结局如此糟糕,很多人都走上了终生成瘾的道路,这并没有阻止普强药厂、科勒曼、美国精神病学协会(APA)和美国国立精神卫生卫生研究所(NIMH)向美国公众兜售阿普唑仑的益处。让百忧解成为畅销产品的相同营销机制又开始启动。普强在APA 1988年的会议上赞助了一个专题讨论会,“专家小组”强调了为期4周的结果。1987年,罗伯特·帕斯诺(Robert Pasnau)曾担任APA负责人,他给APA成员寄出了一本关于“焦虑症的影响”的光鲜小册子,这是普强为了达到“教育目的”所做的努力。舍维特·弗雷泽和杰拉尔德·科勒曼都写了一封“致亲爱的医生”的信,这封信包含在普强发给医生的关于阿普唑仑治疗惊恐障碍的宣传资料中。普强还向APA提供了150万美元,这样它就可以发起一场类似DART(百忧解的宣传项目)的运动,来“教育”精神科医生、医疗工作者和公众有关惊恐障碍的知识,据说惊恐障碍还“未得到充分认识和治疗”[53]。最后,NIMH也参与了这项工作,将惊恐障碍列为优先关注的问题,并在1991年赞助了一次相关会议,随着专家小组指定阿普唑仑为“高效苯二氮类药物”,这让阿普唑仑成为两种“首选治疗”之一[54]。
1990年11月,FDA批准了阿普唑仑作为治疗惊恐障碍的药物,许多报纸和杂志都惯例刊登了特写。《圣路易斯邮报》的头条新闻说:“惊慌失措?治疗就要来了”,该报说,治疗帮助了70%到90%的处于这种虚弱状态的人,这种病折磨着“这个国家400万的成年人”[55]。美联社解释说,“大脑中的生化功能紊乱被认为是惊恐发作的原因之一,阿普唑仑可以通过与大脑中的几个不同系统相互作用来阻止发作。[56]”在《芝加哥太阳时报》上,芝加哥拉什医学院(Rush Medical College)的约翰·扎杰卡(John Zajecka)博士宣称,“阿普唑仑是治疗该疾病最快起效和毒性最小的药物”[57]。又一次,一种非常有效、安全的药物已经上市,1992年,阿普唑仑成为美国的第五大处方药[58]。
非典型抗精神病药也不例外
就在阿普唑仑作为一种治疗惊恐障碍的药物上市的路上时,杨森药厂正在对一种治疗精神分裂症的新药利培酮进行测试。到这个时候,制药公司用来制造新的“重磅”精神药物的方法已经相当成熟了,几乎所有人都采用了百忧解的药物开发模式,因此杨森和礼来、普强一样,设计了有利于其药物的有偏倚的试验。特别是,杨森将多组剂量的利培酮与高剂量的氟哌啶醇进行了比较,因为可以相对肯定的是,与旧的“标准”抗精神病药相比,其中一种利培酮剂量具有良好的安全性。正如FDA评审员所指出的,这些研究“无法”对这两种药物进行任何有意义的比较[59]。在FDA给杨森的批准信中,药物评估办公室主任罗伯特·唐普(Robert Temple)明确表示:
我们会认为利培酮的任何广告或促销标签都是虚假的、误导性的,或缺乏法案第502(a)条和第502(n)条规定的公平的平衡(即只讲优点,不讲缺点),即使有数据表明利培酮在安全性或有效性方面优于氟哌啶醇或任何其他上市抗精神病药物产品[60]。
然而,尽管FDA可以禁止杨森发布广告,宣传其药物优于氟哌啶醇,但它没有权力控制杨森聘用的学界精神病学家发表的言论。这就是20世纪80年代精神病学和制药行业之间出现“合作伙伴关系”的商业佳话。学界医生可以在他们的医学期刊上和公众面前宣称FDA所认为的是错的。在这个案例中,他们在精神病学杂志上发表了20多篇文章,吹捧利培酮在减少精神分裂症(精神失常)的阳性症状方面与氟哌啶醇相当或更优,在改善阴性症状(情感缺乏)方面优于氟哌啶醇。学界医生报告说,利培酮减少了住院时间,提高了患者的社交能力,减少了敌意。“与氟哌啶醇相比,利培酮具有重大的优势,”他们在《临床精神病学杂志(Journal of Clinical Psychiatry)》上写道。“在有效剂量范围内,利培酮对精神分裂症的所有五个维度都有更大的改善。[61]”
这是关于一个新的、改进的治疗手段的科学的故事,他们在媒体的采访中,杨森的研究人员讲述的是奇迹药丸的故事。据《华盛顿邮报》报道,这种新的药物“代表了一种直到最近还被认为是无望的疾病的一线希望。”它解释说,利培酮并没有“引起镇静、视力模糊、记忆受损或肌肉强直,以及与前一代抗精神病药物有关的常见副作用。[62]”《纽约时报》援引杨森临床研究主任理查德·梅巴赫(Richard Meibach)的话报道说,在临床试验中接受利培酮治疗的两千多名患者中“没有出现任何重大副作用”(原注:事实上,84名接受利培酮治疗的患者出现了“严重不良事件”,FDA将其定义为危及生命的事件或需要住院治疗的事件)。报纸说:这种药物被认为是“通过阻断5-羟色胺或多巴胺的过度释放,或共同作用于两者,来缓解精神分裂症症状。[63]”
非典型抗精神病药革命开始了。利培酮显然通过平衡大脑中多种神经递质(让患者)恢复理智,而且似乎没有引起任何副作用。1996年,礼来将再普乐(奥氮平)推向市场,关于非典型抗精神病药奇迹的公开报道提升到另一个档次。
如同以往惯例,FDA总结道:礼来公司采用了“设计上有偏倚的”与氟哌啶醇对比的试验。因此,其大型III期试验(非安慰剂对照)提供了“很少有用的疗效数据”。至于奥氮平的安全性,试验期间有20名患者死亡,22%出现“严重”不良事件(高于用氟哌啶醇的患者),三分之二的患者没有完成研究。数据显示,奥氮平使患者困倦、肥胖,并导致帕金森症状、静坐不能、肌张力障碍、低血压、便秘、心动过速、糖尿病、癫痫、乳房渗液、阳痿、肝功能异常和白细胞紊乱等问题。此外,FDA的保罗·莱伯(Paul Leber)警告说,由于奥氮平阻断了许多类型的神经递质受体,“如果上市后,出现之前未被发现的与奥氮平使用相关的所有类型和所有严重程度的事件报告,没人会感到惊讶。[64]”
这就是试验数据所讲述的故事。礼来公司想在医学杂志和报纸上刊登的故事是:奥氮平比杨森的利培酮好,所以这就是它雇佣的写手所讲述的故事。来自医学院的精神病学家宣布,奥氮平的作用比利培酮或氟哌啶醇更为“全面”,这是一种耐受性良好的药物,实现了全面的改善,它减少了阳性症状,比其他抗精神病药物引起的运动副作用更少,并且改善了阴性症状和认知功能[65]。第二种非典型抗精神病药比第一种更好,《华尔街日报》也从这个角度出发,宣称:奥氮平与其他现有疗法相比,“具有显著的优势”。拉什医学院的约翰·扎杰卡解释道:“真实世界研究中,发现奥氮平比利培酮具有更少的锥体外系副作用。[66]”斯坦福大学(Stanford University)精神病学家艾伦·萨兹博(Alan Schatzberg)告诉《纽约时报》,奥氮平是“一个潜在的重大突破”[67]。
现在唯一的问题似乎是奥氮平是否真的比利培酮更好,在阿斯利康将第三种非典型药物喹硫平推向市场后,媒体就认为新的非典型药物总体上比老药有了显著的改善。《Parade》杂志告诉读者,这些药物“在治疗阴性症状(如推理困难和有条理地说话困难)方面更安全、更有效。[68]”《芝加哥论坛报》宣布,较新的药物“比老药更安全、更有效,它们帮助人们去工作。[69]”在《洛杉矶时报》上写道,“过去精神分裂症患者没有改善的希望。但现在,多亏了新药和相关投入,他们正以前所未有的方式重返社会。[70]”全国精神病联盟(NAMI)也附和着,出版了一本名为《抗精神病药物的突破》的书,书中解释说,这些新药“在平衡所有大脑化学物质(包括多巴胺和5-羟色胺)方面做得更好。[71]”这一直持续下去,最后NAMI的执行董事劳里·弗林(Laurie Flynn)告诉媒体,幸福乐土终于实现了:“这些新药确实是一个突破,它们意味着我们终于可以让人们远离医院,也就是说精神分裂症的长期残疾可以结束了。[71]”
《柳叶刀》问了一个问题
这就是导致精神病药物在美国的使用爆炸性增长发生的讲故事顺序。首先,美国精神病学家把百忧解吹捧为特效药,接着他们把阿普唑仑作为一种安全有效的惊恐障碍治疗手段,最后他们告诉公众非典型抗精神病药物是“突破性”的精神分裂症药物。通过这种方式,他们重振了精神药物的市场,尽管新药物的临床研究没有讲述任何治疗进展。
至少在科学界,围绕着第二代精神药物的“神奇药物”的光环早已消失。正如我们之前所了解到的,2008年有报道称,SSRIs只对严重抑郁症患者有临床意义。现在人们了解到,阿普唑仑比安定更容易上瘾,各种调查人员确定,在服用任意时长的人中,有三分之二的人难以摆脱它[73]。至于最畅销的非典型抗精神病药,这些药物的炒作现在被视为精神病学史上最尴尬的事件之一,因为一个又一个政府资助的研究都没有发现它们比第一代抗精神病药物好。2005年,NIMH的“CATIE试验”确定,非典型抗精神病药和它们的上一代药物“没有显著差异”,更令人不安的是,在这项研究中,无论是新药物还是旧药物,都不能说真的起作用,1432名患者中,74%的患者无法继续服用药物,主要原因是“无效或无法忍受的副作用”[74]。美国退伍军人事务部的一项关于非典型抗精神病药和老一代药物的相对优缺点研究得出了类似的结论,然后,在2007年,英国精神病学家报告说对于精神分裂症患者,如果说有什么区别的话,用老药比用新药有更好的“生活质量”[75]。所有这一切导致两位著名的精神病学家在《柳叶刀》上写道,非典型抗精神病药作为突破性药物的故事现在只能被“视为一种虚构”,“这是一个制药行业为营销目的编造的故事,到现在才被曝光。”然而,他们想知道,“在将近20年的时间里,我们怎么会像一些人所说的那样,被‘欺骗’,而认为它们是更优的药物呢?[76]”
本书的读者可以证明,历史揭示了这个问题的答案。非典型抗精神病药故事的种子是在20世纪80年代初播下的,当时美国精神病学协会(APA)将“生物精神病学”视为一个可以成功向公众推销的故事。这也是一个整个领域都非常想相信的故事,很快南希·安德森(Nancy Andreasen)和其他人讲述了一场正在进行的革命,精神疾病最终没有了它们的生物学秘密,尽管没有人能够准确地解释这些秘密是什么。这个故事引起了公众的兴趣,使公众相信治疗技术正在进步,随着制药公司将新药物推向市场,他们聘请了国内顶尖的精神病专家来讲述这些新的神奇药物是如何“平衡”大脑化学物质的。正是这种对学术医学的选择,才使这个故事具有可信度。这是由哈佛医学院精神病专家杰罗尔德·罗森鲍姆、前NIMH主任杰拉尔德·科勒曼和斯坦福大学精神科医生艾伦·萨兹博讲述的故事。
当然,作为一个社会,我们相信了它。
压制异议
正如我们所看到的,美国精神病学在过去三十年里向公众讲述了一个错误的故事。该领域宣传这样一种观点,即它们的药物可以修复大脑中的化学失衡(其实并没有这回事),并且严重夸大了第二代精神药物的优点。为了让科学进步的故事继续流传下去(并保护它自己对这个故事的信仰),它需要压制关于药物可能造成伤害的言论。
20世纪70年代末,罗兰·莫舍(Loren Mosher)因为进行了索特亚实验而被NIMH开除,从此精神病学界开始了自己的监管工作。下一个被列入精神病学名单的著名精神病医生是彼得·布雷金。尽管他今天以他的“反精神病学”著作而闻名,但他也曾踏上过NIMH的“快车道”,在完成了在哈佛医学院医院(Harvard Medical School hospital)的住院实习期后,他于1966年前往NIMH,致力于发展社区心理健康中心。他在一次采访中回忆道:“我还是那个年少有为的人,我认为我会是哈佛医学院历史上最年轻的精神病学教授,那是我踏上的轨道。[77]”然而,他发现未来属于生物精神病学,而不是他感兴趣的社会精神病学,于是他离开了NIMH去了私人诊所。他很快就开始写关于电击和精神药物的危害的文章,其中他写道这是通过让大脑残疾来发挥作用的。在与美国精神病学协会(APA)领导人进行了多次激烈的斗争之后,布雷金于1987年出现在奥普拉·温弗瑞(Oprah Winfrey,著名主持人)的电视节目中,他在节目中谈到了迟发性运动障碍(TD)以及这种功能障碍是如何证明抗精神病药损害了大脑的。他的言论激怒了APA,并将节目文字记录发给了全国精神疾病联盟(NAMI),后者又向马里兰州医学纪律委员会提出了投诉,要求其吊销布雷金的医疗许可证,理由是他的言论导致精神分裂症患者停止服药(从而造成伤害)。尽管委员会决定不采取任何行动,但它确实进行了调查(而不是草率地驳回了NAMI的申诉),该领域所有人收到的信号,再一次,非常明确。
布雷金说:“我认为有趣的是,罗兰(莫舍)和我在科学上站在问题的两个方面,罗兰认为有一种比药物更好的治疗精神分裂症的方法,我接受了药物、电击和精神外科治疗。这表明你想走哪条路并不重要,他们乐于毁掉你的事业,这就是教训。”
爱尔兰精神病学家大卫·希利经历的事业挫折在某种程度上让人想起了莫舍的失宠。在20世纪90年代,他赢得了该领域顶尖历史学家的声誉,他的著作关注精神药理学时代。他曾担任英国精神药理学(British Association for Psychopharmacology)协会秘书,2000年初,他接受了多伦多大学成瘾与心理健康中心(University of Toronto’s Centre for Addiction and Mental Health)的邀请,负责其情绪与焦虑项目。直到那一刻,他还是精神病学机构内的一员,就像莫舍一样。然而,几年来,他一直对SSRIs是否会引发自杀感兴趣,他最近完成了一项“健康志愿者”研究。在20名志愿者中,有两名在暴露于SSRI后有自杀倾向,这清楚地表明这种药物可能引起这种想法。在接受多伦多的工作后不久,他在英国精神药理学协会的一次会议上展示了他的研究结果。在那里,一位美国精神病学界的顶尖人物警告他别再讲了。希利说:“他告诉我,如果我继续像刚才展示的那样展示结果,我的职业生涯就会毁了,我没有权利揭露这种药片的危害。[78]”
2000年11月,就在他计划在多伦多大学开始新工作的前几个月,希利在学校组织的一次座谈会上作了一次关于精神药理学历史的演讲。在他的演讲中,希利谈到了自1950年代引入抗精神病药以来出现的问题,简要回顾了显示百忧解和其他SSRIs提高了自杀风险的数据,然后顺带观察到今天情感障碍的结果比一个世纪前更糟。他说,如果“我们的药物真的起作用了”,这种情况就不应该发生[79]。
尽管听众们随后将他的演讲评为学术座谈会的最佳内容,但当希利回到威尔士时,多伦多大学已经取消了这份工作邀请。该中心的首席精神病学家大卫·戈德布鲁姆(David Goldbloom)在一封电子邮件中写道:“虽然你作为现代精神病学史的学者受到高度重视,但我们认为你走的方向与我们现有的学术和临床资源开发目标不符。[80]”再一次,该领域的其他人只能吸取到一个教训。希利在一次采访中说:“这一信息表明,直言不讳是个坏主意,而且认为治疗可能不起作用,或者托付给医生来管理可能不是最好的治疗方法,这种想法是无稽之谈。[81]”
许多其他人可以证明,直言不讳是个“坏主意”。加州大学伯克利分校(University of California at Berkeley)的心理学家纳丁·兰伯特(Nadine Lambert)对接受利他林治疗的儿童进行了一项长期研究,发现他们在年轻时可卡因滥用和吸烟的比率都有所上升。她在1998年美国国立卫生研究院(NIH)的一次会议上报告了她的研究结果之后,国家药物滥用研究所(National Institute on Drug Abuse)停止了对她研究工作的资助。2000年,当哈佛医学院精神病学临床讲师约瑟夫·格伦马伦撰写了《抵制百忧解(Prozac Backlash)》一书,详细阐述了与SSRIs的使用有关的许多问题,礼来发起了一场让他名声败坏的运动。一家公关公司收集了几位著名的精神病医生的批评意见,他们嘲笑格伦马伦在这个领域是个“无名小卒”,然后把这些“评论”寄给了各种报纸。哈佛医学院的精神病学家杰罗尔德·罗森鲍姆说:“这是一本不诚实的书,它是经过巧妙处理的,是恶作剧的。”尽管他是格伦马伦的同事,新闻稿自然没有提到罗森鲍姆是礼来的顾问[82]。接下来被攻击的“受害者”是:格雷琴·莱弗尔(Gretchen LeFever),东弗吉尼亚医学院(East Virginia Medical School)的心理学家,她发表的研究表明,弗吉尼亚州学校中被诊断患有注意力缺陷多动障碍(ADHD)的儿童人数过多,之后,一个匿名的“告密者”指控她犯有学术不端行为,她的联邦研究经费被切断,电脑也被查封,虽然她后来澄清了没有任何不端行为,但她的事业仍然脱离正轨。
希利说:“今天精神病学中,在思想控制方面,就像老式的东欧社会控制。”
隐藏证据
很容易用文献证明这三类药物讲的故事是如何导致我们社会产生对精神药物优点的幻想。想象一下,如果在过去的20年里,我们打开报纸,阅读以下发现,我们今天的信念会是什么,这些结果只是我们在本书前面回顾的结果研究的一个样本:
1990年:在一项大型的全国性抑郁症研究中,接受心理治疗的患者18个月的康复率最高(30%),而接受抗抑郁药物治疗的患者(19%)的康复率最低。(NIMH)
1992年:在像印度和尼日利亚这样的贫穷国家,精神分裂症的结果要好得多,在这些国家,只有16%的病人定期服用抗精神病药物,而美国和其他富裕国家的精神分裂症治疗标准是持续用药。(世界卫生组织,WHO)
1995年:在一项对547名抑郁症患者进行的为期六年的研究中,那些接受过这种疾病治疗的患者丧失能力的可能性是没有治疗的患者的近7倍,而且他们“主要社会角色”被“中断”的可能性是其他人的3倍。(NIMH)
1998年:抗精神病药物导致大脑形态学变化,与精神分裂症症状恶化有关。(宾夕法尼亚大学,University of Pennsylvania)
1998年:在世界卫生组织的一项关于“筛查抑郁症的价值”的研究中,那些被诊断和接受过精神药物治疗的人,在一年的时间里,他们的抑郁症状和总体健康状况比那些没有接触过这些药物的人更差。(WHO)
1999年:当长期服用苯二氮类药物的人戒断药物时,他们会变得“更机敏,更放松,更少焦虑。”(宾夕法尼亚大学)
2000年:流行病学研究表明,如今双相情感障碍患者的长期预后比药物治疗时代之前差得多,现代预后的恶化可能是由于抗抑郁药和抗精神病药的有害影响。(礼来药厂;哈佛医学院)
2001年:在一项对1281名因抑郁症短期残疾的加拿大人的研究中,19%服用抗抑郁药的人最终发展为长期残疾,而没有服药的人中只有9%。(加拿大研究人员)
2001年:在前药物时代,双相情感障碍患者的认知能力没有出现长期衰退,但今天他们的认知能力几乎进展得和精神分裂症患者一样严重。(巴尔的摩的谢泼德·巴拉特卫生系统,Sheppard Pratt Health System)
2004年:长期服用苯二氮类药物的人会出现“中到重度”的认知障碍。(澳大利亚科学家)
2005年:天使粉、安非他命和其他诱发精神病的药物都会增加大脑中D2高亲和力受体(D2 HIGH receptors)的数量;抗精神病药物也会在大脑中引起同样的变化。(多伦多大学,University of Toronto)
2005年:在一项对9508名抑郁症患者进行的为期五年的研究中,服用抗抑郁药的患者平均每年有19周出现症状,而那些没有服用任何药物的患者平均为11周。(卡尔加里大学,University of Calgary)
2007年:在一项为期15年的研究中,不服用抗精神病药物的精神分裂症患者中有40%康复了,而接受药物治疗的患者中只有5%。(伊利诺伊大学,University of Illinois)
2007年:长期服用苯二氮类药物的人最终会“显著不适到极度不适(markedly ill to extremely ill)”,经常出现抑郁和焦虑症状。(法国科学家)
2007年:在一项针对诊断为ADHD的儿童的大型研究中,到第三年年底,“药物使用是一个恶化的重要的标志,而不是有益结果的标志。”接受药物治疗的儿童也更容易出现违法行为;他们后来身高也略矮一些。(NIMH)
2008年:在一项针对双相情感障碍患者的全国性研究中,不良结局的主要预测因素是服用抗抑郁药。那些服用抗抑郁药的人成为快速循环者的可能性是未服用者的近4倍,这与不良的长期预后有关。(NIMH)
对报纸档案的检查显示,精神病学机构完全成功地让这些信息无法被公众看到。我在《纽约时报》档案馆和LexisNexis数据库中搜索了报道这些研究的单位,其中涵盖了大多数美国报纸,但我找不到一个能准确报道研究结果的例子。(原注:有报纸评论了我的书《疯狂的美国》,书中提到了世卫组织的贫困国家没有定期服药的精神分裂症患者结果更好的研究,从那时起,这一信息就一定程度上被大家知道。此外,2009年2月,我在圣十字学院(Holy Cross College)的一次演讲中提到了马丁·哈罗(Martin Harrow)长达15年的精神分裂症研究,这导致了2009年2月8日在《伍斯特电报与公报》(马萨诸塞州)上发表了一篇文章讨论了哈罗的工作,这是他研究的消息第一次出现在任何美国报纸上)
当然,报纸很乐意发表这些研究结果。然而,医学新闻通常是以这种方式产生的:科学期刊、国家卫生研究院(NIH)、医学院和制药公司发布新闻稿,吹捧某些发现是重要的,然后记者筛选新闻稿,确定他们认为值得写的。如果没有发布新闻稿,或者医学界没有其他努力来宣传这些发现,那么就不会有任何报道出现。我们甚至可以在NIMH对马丁·哈罗的研究成果的处理中记录下这一信息管控的过程。2007年,也就是他在《神经与精神疾病杂志》上发表研究结果的那一年,NIMH发布了89份新闻稿,其中很多都是关于无关紧要的事情,但是,哈罗的研究结果并没有发表,尽管他的研究可以说是美国有史以来对精神分裂症患者的长期预后最好的研究[83]。可以公平地说,如果结果是相反的,NIMH会吹响新闻发布的号角,全国各地的报纸都会大肆宣扬这一发现。
尽管关于上面列出的大多数研究的报道根本就没有出现在报纸上,但是有几次精神科医生被迫对记者说一些关于其中一项研究的事情,而且每次他们都会歪曲和反转结果。例如,当NIMH公布了注意缺陷多动障碍(ADHD)的MTA研究结果时,它并没有告知公众在第三年使用兴奋剂是“恶化的标志”,相反,它发布了一份新闻稿,标题是:“大多数儿童接受ADHD治疗后病情好转”。这篇文章的标题传达了治疗是有益的,尽管发布的内容确实指出“持续的用药已不再与第三年时的更好结果相关”,它还包含了主要作者彼得·詹森(Peter Jensen)的一句隐晦的话,他说让孩子们继续服用利他林还是有很多理由的,“我们的研究结果表明,如果药物以最佳的剂量持续下去,而不是在儿童的临床病程中开始得太晚,药物治疗可以对一些儿童产生长期的改善。[84]”
如果我们想重新审视这一歪曲过程,我们可以查阅1998年《纽约时报》的一篇文章,其中简要介绍了世卫组织对发达国家和贫穷国家精神分裂症结果的研究。采访了精神病学家关于此研究的看法后,《泰晤士报》的记者写道,“精神分裂症患者在较不发达国家的治疗反应通常比在技术发达的国家好。[85]”“对治疗反应更好”的的说法让读者只能假设印度和尼日利亚的精神分裂症患者比美国和其他发达国家的患者对抗精神病药的反应更好。他们根本不知道在贫穷国家,84%的精神分裂症患者的“治疗”就是没有用药。
2009年7月,我也在NIMH和NAMI的网站上搜索了上面列出的一些研究,我发现了毫无报道。例如,NIMH网站没有讨论现代双相情感障碍结局的显著变差,尽管卡洛斯·萨拉特(Carlos Zarate)是NIMH情绪和焦虑症研究部门的负责人,他曾在2000年撰写了这篇文章,记录了这种恶化。同样,NAMI的网站也没有提供任何关于哈罗研究的信息,尽管它向精神分裂症儿童家长提供了乐观的理由,40%的停药患者在长期内康复了!但这一发现与NAMI数十年来一直向公众宣传的信息直接矛盾,而NAMI的网站也坚持这一信息:它告诉公众,抗精神病药物“纠正了化学失衡,这让脑细胞之间能顺利地相互交流。[86]”
最后,这本书中记录的整个结果研究的历史都没有出现在2008年版的APA精神病学教科书中,这意味着训练成为精神科医生的医学生对这段历史一无所知[87]。这本书没有讨论“超敏感性精神病”,也没有提到抗抑郁药可能是长期的致郁药,它没有报告说双相情感障碍的结果比40年前差得多,没有关于残疾率上升的讨论,没有关于在长期服用精神药物的人身上发现认知障碍的讨论。教科书作者显然熟悉上面列出的16项研究中的许多研究,但是,如果他们提到这些研究,他们就不会讨论关于药物使用的相关事实。教科书写道:哈罗的长期研究表明,有一些精神分裂症患者“在没有得到持续抗精神病药物治疗获益的情况下仍能正常工作。”教科书这句话的作者没有提到未服药组和服药组在恢复率上的惊人差异;相反,他们精心设计了一个句子,讲述了持续抗精神病药物治疗的好处。同样,尽管这本教科书简要讨论了世卫组织关于印度和尼日利亚等贫穷国家精神分裂症患者更好预后的研究,但没有提到这些国家的患者没有定期服用抗精神病药物。在关于苯二氮类药物的一节中,作者承认人们对其成瘾性存在担忧,但随后指出,对于那些长期服用苯二氮类药物的患者来说,其长期疗效总体上是好的,因为大多数患者“保持了治疗获益”。
这个精神病学不敢讲述的故事,表明了我们对精神药物益处的社会幻想并不完全只是无辜受害者。为了向我们的社会推销这种医疗方式的合理性,精神病学不得不严重夸大其新药的价值,使批评者保持沉默,并隐藏长期不良结果的信息。这是一个任性的、故意的过程,而精神病学不得不采用这种讲故事的方法,揭示了这种治疗模式的优点,这远远超过了单单一个的研究所能做到的。
参考文献:
1. D. Healy, Mania (Baltimore: Johns Hopkins University Press, 2008), 132.
2. G. Carson, The Roguish World of Doctor Brinkley (New York: Rinehart & Co., 1960).
3. P. Breggin, Brain-Disabling Treatments in Psychiatry (New York: Springer Publishing Co., 2008), 390.
4. “Fluoxetine project team meeting,” July 31, 1978, accessed at healyprozac.com.
5. “Fluoxetine project team meeting,” July 23, 1979, accessed at healyprozac.com.
6. J. Cornwell, The Power to Harm (New York: Viking, 1996), 147–48.
7. D. Healy, Let Them Eat Prozac (New York: New York University Press, 2004), 39.
8. Ibid, 128.
9. Ibid, 249.
10. BGA letter to Eli Lilly, May 25, 1984, Forsyth v. Eli Lilly trial documents, exhibit 42. See http://baumhedlundlaw.com/media/timeline.
11. Forsyth v. Eli Lilly trial documents, exhibit 58.
12. Cornwell, The Power to Harm, 198.
13. Healy, Let Them Eat Prozac, 35.
14. P. Breggin, Talking Back to Prozac (New York: St. Martin’s Press, 1994), 41.
15. Ibid, 46.
16. Ibid, 90. Also see P. Breggin, Brain-Disabling Treatments in Psychiatry, 79, 86, 91.
17. D. Graham, “Sponsor’s ADR submission on fluoxetine dated July 17, 1990,” FDA document, September 1990.
18. T. Moore, “Hard to Swallow,” Washingtonian, December 1997.
19. D. Kessler, “Introducing MEDWatch,” Journal of the American Medical Association 269 (1993): 2765–68.
20. J. Bremner, “Fluoxetine in depressed patients,” Journal of Clinical Psychiatry 45 (1984): 414–19.
21. J. Feigner, “A comparative trial of fluoxetine and amitriptyline in patients with major depressive disorder,” Journal of Clinical Psychiatry 46 (1985): 369–72.
22. J. Cohn, “A comparison of fluoxetine, imipramine, and placebo in patients with major depressive disorder,” Journal of Clinical Psychiatry 46 (1985): 26–31.
23. J. Wernicke, “The side effect profile and safety of fluoxetine,” Journal of Clinical Psychiatry 46 (1985): 59–67.
24. P. Stark, “A review of multicenter controlled studies of fluoxetine vs. imipramine and placebo in outpatients with major depressive disorder,” Journal of Clinical Psychiatry 46 (1985): 53–58.
25. S. Levine, “A comparative trial of a new antidepressant, fluoxetine,” British Journal of Psychiatry 150 (1987): 653–55.
26. R. Pary, “Fluoxetine: prescribing guidelines for the newest antidepressant,” Southern Medical Journal 82 (1989): 1005–9.
27. D. Regier, “The NIMH depression awareness, recognition and treatment program,” American Journal of Psychiatry 145 (1988): 1351–57.
28. Healy, Let Them Eat Prozac, 9.
29. F. Schumer, “Bye-Bye, Blues,” New York, December 18, 1989.
30. G. Cowley, “Prozac: A Breakthrough Drug for Depression,” Newsweek, March 26, 1990.
31. N. Angier, “New antidepressant is acclaimed but not perfect,” New York Times, March 29, 1990.
32. B. Duncan, “Exposing the mythmakers,” Psychotherapy Networker, March/April 2000.
33. M. Waldholz, “Prozac said to spur idea of suicide,” Wall Street Journal, July 18, 1990.
34. Ibid. Also see S. Shellenbarger, “Eli Lilly stock plunges $4.375 on news of another lawsuit over Prozac drug,” Wall Street Journal, July 27, 1990.
35. Memo from Leigh Thompson to Allan Weinstein, February 7, 1990, accessed at http://healyprozac.com
36. Memo from Mitch Daniels to Leigh Thompson, “Upcoming TV appearance,” April 15, 1991, accessed at healyprozac.com.
37. Ibid.
38. T. Burton, “Medical flap: Anti-depression drug of Eli Lilly loses sales after attack by sect,” Wall Street Journal, April 19, 1991.
39. L. Garnett, “Prozac revisited,” Boston Globe, May 7, 2000.
40. R. Behar, “The Thriving Cult of Greed and Power,” Time, May 6, 1991.
41. T. Burton, “Panel finds no credible evidence to tie Prozac to suicides and violent behavior,” Wall Street Journal, September 23, 1991.
42. S. Begley, “Beyond Prozac,” Newsweek, February 7, 1994.
43. P. Breggin, Toxic Psychiatry (New York: St. Martin’s Press, 1991), 348–50. In this book, Breggin detailed the bad science involved in the Xanax trials, the co-opting of academic psychiatry, and the involvement of the APA in marketing the drug.
44. “High Anxiety,” Consumer Reports, January 1993.
45. C. Ballenger, “Alprazolam in panic disorder and agoraphobia,” Archives of General Psychiatry 45 (1988): 413–22.
46. R. Noyes, “Alprazolam in panic disorder and agoraphobia,” Archives of General Psychiatry 45 (1988): 423–28.
47. J. Pecknold, “Alprazolam in panic disorder and agoraphobia,” Archives of General Psychiatry 45 (1988): 429–36.
48. Ballenger, “Alprazolam in panic disorder.”
49. Noyes, “Alprazolam in panic disorder.”
50. Pecknold, “Alprazolam in panic disorder.”
51. I. Marks, “The ‘efficacy’ of alprazolam in panic disorder and agoraphobia,” Archives of General Psychiatry 46 (1989): 668–72.
52. I. Marks, “Reply to comment on the London/Toronto study,” British Journal of Psychiatry 162 (1993): 790–94.
53. Breggin, Toxic Psychiatry, 344–53.
54. F. Pollner, “Don’t overlook panic disorder,” Medical World News, October 1, 1991.
55. J. Randal, “In a panic?” St. Louis Post-Dispatch, October 7, 1990.
56. H. Brown, “Panic attacks keeps thousands from malls, off roads,” Associated Press, November 19, 1990.
57. R. Davis, “When panic is disabling,” Chicago Sun-Times, June 29, 1992.
58. “High Anxiety,” Consumer Reports.
59. FDA reviews of risperidone data included the following written commentaries: reviews by Andrew Mosholder, May 11, 1993, and November 7, 1993; David Hoberman, April 20, 1993; and Thomas Laughren, December 20, 1993.
60. Approval letter from Robert Temple to Janssen Research Foundation, December 29, 1993.
61. S. Marder, “The effects of risperidone on the five dimensions of schizophrenia derived by factor analysis,” Journal of Clinical Psychiatry 58 (1997): 538–46.
62. “New hope for schizophrenia,” Washington Post, February 16, 1993.
63. “Seeking safer treatments for schizophrenia,” New York Times, January 15, 1992.
64. FDA reviews of olanzapine data included the following written commentaries: reviews by Thomas Laughren on September 27, 1996; by Paul Andreason on July 29 and September 26, 1996; and by Paul Leber on August 18 and August 30, 1996.
65. C. Beasley, “Efficacy of olanzapine,” Journal of Clinical Psychiatry 58, suppl. 10 (1997): 7–12.
66. “Psychosis drug from Eli Lilly racks up gains,” Wall Street Journal, April 14, 1998.
67. “A new drug for schizophrenia wins approval from the FDA,” New York Times, October 2, 1996.
68. “Schizophrenia, close-up of the troubled brain,” Parade, November 21, 1999.
69. “Mental illness aid,” Chicago Tribune, June 4, 1999.
70. “Lives recovered,” Los Angeles Times, January 30, 1996.
71. P. Weiden, Breakthroughs in Antipsychotic Medications (New York: W.W. Norton, 1999), 26
72. Wall Street Journal, “Psychosis drug from Eli Lilly.”
73. “High Anxiety,” Consumer Reports.
74. J. Lieberman, “Effectiveness of antipsychotic drugs in patients with schizophrenia,” New England Journal of Medicine (2005): 1209–33.
75. L. Davies, “Cost-effectiveness of first-v. second-generation antipsychotic drugs.” British Journal of Psychiatry 191 (2007): 14–22.
76. P. Tyrer, “The spurious advance of antipsychotic drug therapy,” Lancet 373 (2009): 4–5.
77. Interview with Peter Breggin, October 10, 2008.
78. Healy interview on CBS News and Current Affairs, June 12, 2001.
79. D. Healy, “Psychopharmacology and the government of the self,” talk given November 30, 2000, at the University of Toronto.
80. E-mail from David Goldbloom to David Healy, December 7, 2000.
81. Interview with Healy by e-mail, July 4, 2009.
82. Memo from Larry Carpman to Steve Kurkjian, April 11, 2000.
83. “Science News from 2007,” NIMH website, accessed on July 2, 2009.
84. NIMH press release, July 20, 2007.
85. J. Sharkey, “Delusions; paranoia is universal,” New York Times, August 2, 1998.
86. Search of NAMI website on July 7, 2009.
87. R. Hales, The American Psychiatric Publishing Textbook of Psychiatry (Arlington, VA: American Psychiatric Publishing, 2008).











